MU Wien:Computerunterstützte Diagnose und Therapie VU (Kaiser)/Prüfungsfragen 2009-01-26
Computerunterstützte Diagnose & Therapie : Fragenkatalog[Bearbeiten | Quelltext bearbeiten]
Frage 01: Nennen Sie Gründe für die Forderung nach einer Computerunterstützung in der Diagnose und Therapie.[Bearbeiten | Quelltext bearbeiten]
- Qualitätssicherung (um menschliche Fehler zu vermeiden = führende Todesursache in den USA)
- Einheitliche Standards
- Kostengründe
- Fort-/Weiterbildung
Frage 02: Beschreiben Sie den diagnostisch-therapeutischen Kreislauf.[Bearbeiten | Quelltext bearbeiten]
Nimm bitte das Diagramm in den Unterlagen Einheit1/Seite9 vor euch! Das Diagramm aufzuzeichnen sollte ausreichen aber unten ist trotzdem eine Erklaerung.
PATIENT --Daten--> BEOBACHTUNG --Information--> ENTSCHEIDUNG --Diagnose--> PLAN --Therapie--> PATIENT
In dem diagnostischen-therapeutischen Kreislauf geht man von einem Patienten aus. Von dem Patienten kann man auf verschiedene Wege (Anamnese, Labor etc.) Daten sammeln. Erst durch eine Beobachtung kann man die Relevanz der Daten entscheiden und sie damit in Informationen umwandeln. Die gesammelten Informationen resultieren in einer Entscheidung über die Diagnose. Die Diagnose wiederum führt zur Planung der Therapie für den Patienten.
Die wichtigsten Schritte in dem Kreislauf sind:
1. Beobachtung (aufgrund der zugrunde liegenden Daten)
2. Diagnose (wird entschieden aufgrund der zugrunde liegenden Informationen)
3. Therapie (wird entsprechend der Diagnose geplant und dann durchgeführt)
Der Kreislauf kann einmal (z.B. bei einer Beratung)oder mehrmal (z.B Monitoring in der ICU) durchlaufen werden.
Frage 03: Geben Sie eine Definition für den Begriff "Diagnose". Erklären Sie den "diagnostischen Prozess"?[Bearbeiten | Quelltext bearbeiten]
Diagnose ist die Analyse vorhandener Daten oder Befunden, um eine pathophysiologische Erklärung für die Symptome eines Patienten zu bestimmen.
Diagnostischer Prozess:
- 1. Erstellen einer ersten Einschätzung, wie wahrscheinlich ein Patient eine Krankheit hat -> A-priori-Wahrscheinlichkeit. Diese erste Einschätzung wird aufgrund von Vorwissen über die Krankheit gewonnen.
- 2. Sammeln von weiteren Informationen, oftmals durch Ausführen von diagnostischen Tests.
- 3. Aktualisieren der ersten Wahrscheinlichkeitsschätzung -> A-posteriori-Wahrscheinlichkeit.
Was nachher kommt. Das Eintreten der ersten Einschätzung wird nach Kenntnis von weiteren Informationen bewertet.
Frage 04: Erklären Sie das „hypothetico‐deduktive Verfahren“.[Bearbeiten | Quelltext bearbeiten]
schaut euch bitte die 2 Abbildungen an:
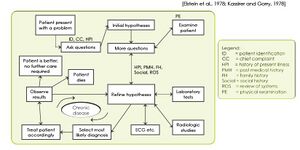
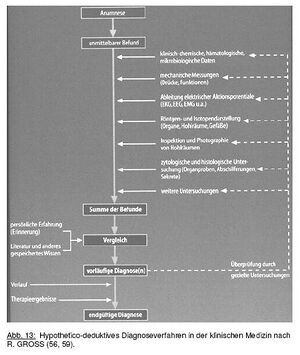
-
Frage 05: Diagnostische Test werden mittels der Maße "Sensitivität" und "Spezifität" bewertet.Was sagen diese beiden Maße aus?[Bearbeiten | Quelltext bearbeiten]
- Sensitivität: Anteil der tatsächlich Test-Positiven unter den Kranken
d.h. Kranke sollen korrekt als Kranke identifiziert werden.
- Spezifität: Anteil der tatsächlich Test-Negativen unter den Gesunden
d.h. Gesunde sollen korrekt als gesund identifiziert werden.
Man kann mit diesen beiden 'measures' die diagnostischen Tests bewerten. Zentral dabei ist die Frage, ob ein Test bei einer Menge von Symptomen exakt oder fast gar nicht auf die korrekte Diagnose hinweist.
Frage 06: ROC-Kurven[Bearbeiten | Quelltext bearbeiten]
Frage: Mittels ROC-Kurven wird die Performance von Tests verglichen. Wie werden ROC-Kurven erstellt? Was sagen diese aus? Welche Probleme gibt es bei der Erstellung von ROC-Kurven?

Receiver operating characteristic(ROC)-Kurven werden hergestellt, indem man folgende Werte in einem Koordinatensystem einträgt: Sensitivität (die relative Häufigkeit aller richtige positiven Testergebnisse) als y-Achse und 1-Spezifität (die relative Häufigkeit aller falsch positiven Testergebnisse) als x-Achse. Es resultiert eine gekrümmte, parabelartige Kurve. Der Testgrenzwert wird aus dem Kontaktpunkte einer 45° ansteigenden Tangente mit der ROC-Kurve angegeben.
ROC-Kurven sind zum Testen einer Diagnose anwendbar und dies durch das Vergleichen von zwei Methoden. Wenn die Kurven schnell in Richtung der rechten oberen Ecke des Diagramms läuft, oder wenn der Wert des Bereichs unter der Kurve groß ist, dann verläuft der Test gut. Der Test ist aber schlecht, wenn der Bereich bei 0,5 liegt.
Problem: Das Aufzeichnen der Testwerte in das gleiche Diagramm führt zu einer grafischen Ungenauigkeit.
Frage 07: Beschreiben Sie die 4 Schlüsselfunktionen eines Diagnosesystems:[Bearbeiten | Quelltext bearbeiten]
1. Administrativ: Aufbereiten der medizinischen Daten uund der Dokumentation; Bewilligung von Maßnahmen oder Überweisungen
2. Verwaltung des Kliniksystems: Überwachen von Patienten in Forschungs- und Chemotherapie-Studien; Nachverfolgen von Anweisungen, Überweisungen zu Nachfolgeterminen und vorbeugenden Maßnahmen
3. Kostenkontrolle: Überwachung von Verschreibungen; Vermeiden von doppelten oder unnötigen Tests
4. Entscheidungsunterstützung: Unterstützen von Diagnose und Therapie-Prozessen; Fördern der Anwendung von optimalen Verfahren und Leitlinien
Frage 08: Wie können Expertensysteme charakterisiert werden?[Bearbeiten | Quelltext bearbeiten]
Charakterisierung von klinischen Expertensysteme:
1. Beabsichtigte Funktion des Systems
- Die Funktion des Systems kann entweder dem Arzt sagen "was, bezüglich der Patientin, wahr ist" (also eine korrekte Diagnose stellen) oder "was zu tun ist" (also die Vorgehensweise nach einer Diagnose angeben). Es gibt auch Systeme die beide Funktionalitäten unterstützen.
2. Modus durch den Auskunft angeboten wird
- Passive Rolle: Das System wartet auf die BenutzerIn, bevor es etwas unternimmt.
- Aktive Rolle: Das System wartet NICHT auf MedizinerInnen/BenutzerInnen sondern handelt selbstständig
3. Art der Beratung
- Beratungsmodel: Das System gibt seine Idee zurück
- Krikitmodel: Das System gibt Feedback zu den eigenen Ideen der BenutzerIn.
- User: "DiagnoseX ist der Fall"
- System: "Wahrscheinlichkeit, mit der DiagnoseX der Fall ist"
- System: "Wenn du höhere Wahrscheinlichkeit willst, führe diese Tests durch."
4. Zugrundeliegender Entscheidungsfindungsprozess
Es existieren verschiedene Möglichkeiten:
- Bayesiche Diagnose-Programme (Wahrscheinlichkeiten)
- Decision Analysis (ähnlich wie Bayes, nur inklusive Kosten)
- Artifical Neural Networks (ANN) (liefert keine Begründung für den Output)
- Wissensbasierte Systeme (Fakten + Regeln)
5. Faktoren bezüglich der Mensch-Computer-Interaktion
- Entscheidungsfindung in Workflow/Arbeitsroutine integrieren
- Antworten auf die hypothetische Frage des Users: "Was passiert, wenn ich x tue"
Frage 09: Welche Methoden der Diagnostik kennen Sie, die sich für die Behandlung von unsicherem Wissen eignen?[Bearbeiten | Quelltext bearbeiten]
- Fallbasierte Diagnostik:
- Behandlung neuer Fälle durch Vergleich mit Falldatenbank
- Problem: Wie kann man Ähnlichkeiten zwischen den Fällen (reproduzierbar) feststellen?
- Statistische Diagnostik:
- Symptom-Diagnose-Tabellen durch statistische Auswertung großer Mengen von Falldaten
- Kausale Diagnostik:
- Erklärung beobachteter Symptome in einem vorgegebenen Modell
- Heuristische Diagnostik:
- Geschätzte Symptom-Diagnose-Wahrscheinlichkeit
- Flexible Berücksichtigung von Symptom-Kombinationen, -Ausnahmen, etc.
Frage 10: Beschreiben Sie die Merkmale von heuristischer Diagnostik, wie sie beispielsweise in regelbasierten Systemen gegeben sind![Bearbeiten | Quelltext bearbeiten]
- Man hat Unsicherheiten in Symptomen, Symptomkombinationen, Zwischen- und Enddiagnosen
- Bewertung der Unsicherheiten von menschlichen Experten
- Heuristische Regeln besitzen grundlegend die Form „Merkmal (Symptom) m deutet auf Lösung (Diagnose) l mit Unsicherheit x hin“
- Schrittweise Abstraktion von Symptomen zu Diagnose
- Merkmalsabstraktion auf Konzepte basiert auf der Fachsprache der Domäne
Frage 11: Beschreiben Sie die Schritte bei der heuristischen Diagnostik![Bearbeiten | Quelltext bearbeiten]
- Strategien zur Regelverknüpfung (Abarbeiten von Regeln)
- Vorwärtsverkettung: ausgehend von den eingegebenen Symptomen werden alle anwendbaren Regeln ausgewertet
- Rückwärtsverkettung: ausgehend vom Ziel (z.B. Infektionsursache finden) werden alle Regeln ausgewertet, die zum Erreichen des Ziels beitragen; unbekannte Daten erfragen
- Kontrollstrategien (Dialogstrategie bei Erfragung unbekannter Fakten)
- Establish-Refine-Strategie
- Hypothesize-and-Test:
- Eingabe: Symptome
- Ausgabe: geordnete Liste von Diagnosen
- 1. Für jedes neue Symptom S:
- 2. Addiere alle mit S assoziierten Diagnosen zur Liste der aktiven Diagnosen
- 3. Bewerte die Diagnosen
- 4. Ordne die Diagnosen
- 5. Frage nach einem unbekannten Symptom der höchstbewerteten Diagnose;
- 6. Falls vorhanden: gehe zu 1.
- 7. sonst: gib aktuelle Liste der Diagnosen als Ergebnis aus
- Schritt 2-4 ist Vorwärtsverkettung
- Schritt 5-7 ist Rückwärtsverkettung
Frage 12: Welche Gründe verhindern oft den Einsatz von Diagnosesystemen in der Praxis?[Bearbeiten | Quelltext bearbeiten]
- Integration des Diagnosesystems in das bestehende Krankenhausinformationssystem gestaltet sich oftmals schwierig
- Umgang schwierig (lange Einarbeitungszeit)
- Für den Arzt sehr zeitaufwändig => Zeit fehlt bei den Patienten
- Vertrauen der Ärzte in das System fehlt
- Trotz großer Wissensbasis über viele Krankheiten keine Information
- Wartung der Wissensbasis durch eine Expertengruppe teuer und zeitaufwändig
- Diagnosesysteme sind noch größtenteils im Forschungsstadium und zielen derzeit mehr auf den Einsatz in der Ausbildung denn auf den Routinebetrieb ab
Frage 13: Was versteht man unter "Evidenz-basierter Medizin" (EbM)? Geben Sie Gründe für die Entwickelung von EbM an.[Bearbeiten | Quelltext bearbeiten]
Definition: Evidenzbasierte Medizin (EbM) ist der gewissenhafte, ausdrückliche und vernünftige Gebrauch der gegenwärtig besten externen Evidenz für Entscheidungen in der medizinischen Versorgung individueller Patienten. Die Praxis der EbM bedeutet die Integration individueller klinischer Expertise mit der best verfügbaren externen Evidenz aus systematischer Forschung.“ (David L. Sackett u. a.: Was ist evidenz-basierte Medizin und was nicht?)
Gründe für die Entwickelung:
- Das medizinische Wissen verdoppelt sich alle 5-10 Jahre.
- Publikationen sind nicht mehr überblickbar um Neuerungen in einem bestimmten Feld wahrzunehmen.
- Durch die große Anzahl von wissenschaftlichen Studien kann man nicht mehr entscheiden welche Studien als Basis für medizinische Praxis verwendet werden sollen. (Studien sind oft unklar, verwirrend oder widersprüchlich)
Das Ziel der EbM ist also, die Qualität der veröffentlichten medizinischen Daten zu bewerten und verbessern.
Frage 14: Erklären Sie die Vorgehensweise beim EbM! [Bearbeiten | Quelltext bearbeiten]
- 1.Formulieren der Frage: "Person in question, Intervention given, Comparision and Outcomes considered" (PICO),
- P: Wie beschreibe ich eine Patientengruppe ähnlich meiner?
- I: Welche Art von Intervention ziehe ich in Betracht ?
- C: Was ist die hauptsächlich vergleichbare Alternative zu den in Betracht gezogenen Alternativen?
- O: Was kann ich erreichen?
- 2. Analysieren der Evidenz:
Suche nach Dokumenten, die sich auf verschiedene klinische Fragestellungen beziehen ( Sammlungen med. Literatur, Datenbanken)
- 3. Kritische Evaluierung :
"Critical Appraisal Skills Programme" (CASP) Mediziner sollen Fähigkeiten entwickeln, um die Evidenz über klinische Effektivität von Vorschlägen zu beurteilen
- 1. Sind die Resultate zuverlässig?
- 2. Was sind die konkreten Resultate?
- 3. Helfen die Resultate bei unserem lokalen Problem?
- 4. Anwenden der Evidenz
Frage 15. Welche klinische Studientypen gibt es in der Medizin? Beschreiben Sie diese Kurz![Bearbeiten | Quelltext bearbeiten]
- Randomized controlled trials (RCTs)
Studiengruppe durch zufällige Auswahl getroffen, "Gold Standard". Zufällig heißt, dass die Gruppenzuweisung so passiert, dass die relevanten Eigenschaften (z.B. Geschlecht, Alter, ...) möglichst gleichverteilt sind.
- Cohort Study
Teilnehmer eine Studiengruppe teilen sich eine oder mehrere Charakteristika wie Erfahrungen, Verfassung, Zustand.
Beobachtung über bestimmten Zeitraum, Vergleich der Verfassung während eines früheren Zeitraums mit der Verafassung während eines späteren Zeitraumes.
- Case-control study
Teilnehmer einer Studiengruppe haben eine spezifische Beeinträchtigung oder Krankheit; Kontrollgruppe ohne diese Beeinträchtigungen oder Krankheit; Meist zur Ursachenfindung eines bestimmten Zustands
- Cross-sectional survey
Krankheits und Belastungsstatus gleichzeitig gemessen; Datenerhebung zu einem Zeitpunkt, beziehen sich aber auch auf die Vergangenheit; gut für Identifikation der Prävalenz einer Krankheit; kann keine Zeitliche Beziehung zw. angenommener Ursache und einem Effekt etablieren
- Cross-over design
Patienten erhalten spezielle Therapieren, spezifische Reihenfolge oder zufällige Reihenfolge; jeder Patient ist seine eigene Kontrollgruppe; Unterschied zw. inidividual Thearpien oder eine Abfolge von Therapien gut ersichtlich
- Case report und case Series
Krankheitsgeschichte eines Patienten in Form einer Erzählung, Mehrere Case reports ergeben case series
Frage 16: Was sind medizinische Leitlinien? Was sind Protokolle?[Bearbeiten | Quelltext bearbeiten]
- Medizinische Leitlinien: enthalten allgemeine Empfehlungen oder Anweisungen die dem Arzt (dem Patienten / dem Angehörigen) als Entscheidungshilfe dienen. Die Empfehlungen und Anweisungen basieren auf wissenschaftlichen Forschungsergebnissen und daran anschließender Experten-Diskussionen, um die bestmögliche medizinische Versorgung zu erzielen.
- Protokolle: dienen mehr zur Direkthilfe. Anstatt allgemeinen Empfehlungen oder Anweisungen wird präzise beschrieben, wie bestimmte Patienten medizinisch versorgt werden sollen. Außerdem sind die Anweisungen auf bestimmte Standorte (z.B.: Krankenhaus) angepasst.
Frage 17. Erklären sie den Unterschied zwischen "consensus-based" und "evidence-based" guidelines ? [Bearbeiten | Quelltext bearbeiten]
- Consensus-Based
Entwickelt in Übereinstimmung einer Gruppe von Experten
- Evidence-based Guideline
Entwickelt nach systematischem Erwerb und Beurteilung von Information aus der Literatur.
Frage 18: Eigenschaften von Leitlinien[Bearbeiten | Quelltext bearbeiten]
Frage: Welche (11) Eigenschaften müssen Leitlinien aufweisen?
- Validität/Gültigkeit: korrekte Interpretation wissenschaftlicher Erkenntnisse
- Reliabilität/Zuverlässigkeit: gleiche klinische Umstände -> jede Ärztin benutzt Leitlinie ähnlich
- Reproduzierbarkeit der Empfehlungen
- Repräsentative Entwicklung der Leitlinie: alle beteiligten Disziplinen verhältnismäßig involviert
- Klinische Anwendbarkeit
- Klinische Flexibilität: Ausnahmefälle aufzeigen, Bedürfnisse des Patienten können Entscheidungen verändern
- Klarheit der Definitionen und Empfehlungen
- Genaue Dokumentation, wie die Leitlinie entstanden ist (Annahmen, Studien, Erfahrungen)
- Planmäßige Überprüfung
- Überprüfung der Anwendung: Verfahren aufzeigen, wie Akzeptanz der Empfehlungen in der Praxis überprüft werden kann
- Kosten-Nutzen-Verhältnis berücksichtigen (gute Versorgung, akzeptable Kosten)
Frage 19: Wie wird Evidenzinformation in Leitlinien dargestellt? Welche Probleme können sich daraus ergeben?[Bearbeiten | Quelltext bearbeiten]
- Levels of Evidence (LoE)
- LoEs beschreiben die Qualität der Evidenz
- Werden meist explizit in Leitlinien angegeben, aber mit unterschiedlichen Symbolen (A,B,1++,I,IIa)
- Attribute dieser Levels:
- Studiendesign (Meta-Analyse, Systematic Review, RCTs, …)
- Studienqualität (basierend auf Methoden und Ausführung)
- Stärke der Empfehlung (Strengths of Recommendations -SoRs)
- SoR hängt von mehreren Faktoren ab:
- Level of Evidenz von individuellen Studien
- Art der Ergebnisse, die in diesen Studien gemessen werden
- Anzahl, Beschaffenheit und Zusammenhang der Evidenz als Ganzes
- SoR hängt von mehreren Faktoren ab:
- Beziehung zwischen Nutzen, Schaden und Kosten
- Definition zwischen Nutzen und Schaden:
- Klarer Nutzen: Die Vorteile überwiegen deutlich über die Schäden.
- Nutzen: Die empfohlene Intervention macht ausdrücklich mehr Nutzen als Schaden.
- Unklares Gleichgewicht: Es ist unklar, ob die empfohlene Intervention nicht mehr schadet, als Nutzen bringt.
- Kein klarer Nutzen: Der Nutzen überwiegt nicht mehr dem Schaden
- Definition zwischen Nutzen und Schaden:
Daraus ergebende Probleme:
- Da die LoE von verschiedenen Organisationen verschieden definiert werden, erschwert das die Vergleichbarkeit. Es gibt leider keinen Standard, der die einzelnen Evidenzstufen genau festlegt.
Frage 20: Adaption von Leitlinen[Bearbeiten | Quelltext bearbeiten]
Frage: Wieso ist es notwendig, Leitlinien zu "adaptieren", um sie in einer Organisation einzuführen? Welche systematischen Vorgehensweisen gibt es? Beschreiben Sie kurz eine Vorgehensweise.
Nationalen Leitlinien fehlt häufig der Adressatenbezug: Praktizierende Ärzte akzeptieren Leitlinien, deren Empfehlungen keinen Bezug zur individuellen Situation des Berufsalltages haben, nur selten. Aus diesem Grund wird regionalen Institutionen (Arztpraxen, Praxisverbünden, Kliniken) die Adaption von Leitlinien empfohlen.
Adaptions Vorgehensweise:
1. Themenauswahl (durch Identifizierung prioritärer Versorgungsprobleme der Organisation – z. B. Praxisnetz).
2. Recherche; Qualitätsbewertung und Vorauswahl überregionaler Leitlinien
2. Inhaltliche Analyse der Leitlinien und Auswahl/Adaptation der relevanten Empfehlungen (durch Repräsentanten der Organisation – "Leitliniengruppe"), gegebenenfalls ergänzt durch Evidenz aus weiteren Quellen (z. B. Originalliteratur).
4. Dokumentation der Empfehlungen als interne Handlungsempfehlung
Alternative Ausarbeitung[Bearbeiten | Quelltext bearbeiten]
( Ich glaub, die obige Ausarbeitung trifft die Frage nicht ganz (die Adaption wird nur allgemein beschrieben), deswegen im Folgenden noch ein Versuch)
Nationalen Leitlinien fehlt häufig der Adressatenbezug: Praktizierende Ärzte akzeptieren Leitlinien, deren Empfehlungen keinen Bezug zur individuellen Situation des Berufsalltages haben, nur selten. Aus diesem Grund wird regionalen Institutionen (Arztpraxen, Praxisverbünden, Kliniken) die Adaption von Leitlinien empfohlen.
Zwei Ansätze für die Anpassung von Leitlinien:
- Practice Guideline Evaluation and Adaption Cycle (PEAC)
- Guideline adaptation proposed by ADAPTE working group (ADAPTE)
Bei ADAPTE geht man kurz folgendermaßen vor:
- Die Klinischen Fragen, um die es geht, festlegen
- Nach Guidelines suchen
- Die Guidelines selektieren
- Guidelines beurteilen (Kriterien: Qualität, Konsistenz, Anwendbarkeit)
- Die Empfehlungen an die lokalen Gegebenheiten/den Anwendungskontext anpassen
- Externe Experten reviewen den Guideline-Entwurf
- Guideline adaptieren/übertragen/implementieren
Frage 21: Computerunterstützte Leitlinien [Bearbeiten | Quelltext bearbeiten]
Warum Computerunterstützung:
- Patientenspzifische Empfehlungen
- Automatische Erinnerungen (reminder), Alarme (alerts)
- Entscheidungsunterstützung und Aufgabensteuerung
- Überprüfung der Richtigkeit von Bestelleingaben, Verschreibungen, Überweisungen, etc.
- Hintergrund monitoring, care plans, Qualitätsprüfung
Vorteile:
- Automatische Entscheidungsunterstützung bereits beim ersten Patientenkontakt
- Integration in den Arbeitsablauf
- Qualitätssicherung (retrospektive Analyse ob Behandlung korrekt war)
- Simulationen (für Ausbildungszwecke)
- Aublauf ist übersichtlich (--> Interaktive, dynamische Ansichten von Pfaden)
Frage 22: Workflow-Systeme[Bearbeiten | Quelltext bearbeiten]
Therapien besitzen trotz genauer Vorgaben einen gewissen Grad an Flexibilität. Bei einer signifikanten Anzahl von Fällen treten Ausnahmen auf, bei denen in vorgeschriebener, aber nicht im Workflow modellierter Weise vom geplanten Behandlungsverlauf abgewichen werden muss. Um Workflow-Systeme dennoch einsetzen zu können, ist es notwendig die laufenden Workflows zu adaptieren (d.h. zu verändern), um sie an die neue Therapiesituation anzupassen.
Zur Methodik in kurzen Worten (gibt ganze Diplomarbeiten darüber):
Das geschieht mittles Kombination einer Workflowtechnologie und einer Wissensbasis. Mit dem WfMS wird der Thearapieablauf modeliert. Die Wissensbasis enthält medizinisches Domänenenwissen und kann mit dessen Hife Ausnahmen erkennen. Treten diese auf können Adaptionen des Workflows vorgenommen werden.
(Ausnahmen bei der Therapie sind z.B.: Nebenwirkungen bestimmter Medikamente)
Frage 23: Beschreiben Sie einen (selbstgewählten) Formalismus für computerinterpretierbare Leitlinien/Protokolle[Bearbeiten | Quelltext bearbeiten]
Asbru: Zurückzuführen auf einem Dialog zwischen medizinischem Personal und wissensbasierten Systemen. (Wissensbasierte Systeme können primär nur auf elektronisch gespeicherte Patientendaten zugreifen, med. Personal/Arzt hat Zugriff auf weitere klinische Informationen und verfügen über med. Wissen).
Asbru ermöglicht die Repräsentation von zeitbezogenen Protokollen mit entsprechenden med. Intentionen. Protokoll wird in Asbru Plan genannt. Ein Plan kann aus mehreren Subplänen bestehen. Subpläne und Pläne haben den gleichen Aufbau. Protokoll besteht aus Protokollnamen, einer Menge von Argumenten, Präferenzen, Intentionen, Bedingungen, Effekten und einem Plankorpus (optional). Die Darstellung der klinischen Richtlinien und Protokolle erfolgt in XML.
Präferenzen: beeinflussen und beschränken die Auswahl von auszuführenden Plänen Intentionen: beschreiben Ziele eines Plans Bedingungen: spezifizieren wann ein Plan aktiviert, unterbrochen und abgebrochen wird Effekte: beschreiben die Auswirkungen von Plänen Plankorpus: beinhaltet verfeinerte Subpläne
Beispiel: Plankomponente Präferenzen
Ausführungsplan benötigt für 1 bis 2 Stunden ein „device-A“. Die geschätzten Kosten betragen ca. 100€. Die Beschwerden des Patienten sind als niedrig einzustufen. Die Strategie wird konservativ eingestuft und der Patient ist für die Durchführung der Aktion selbst verantwortlich.
<preferences responsible-actor="patient" strategy="conservative">
<resource-constraint name="device-A" type="obligatory">
<time-annotation>
<time-range>
<duration>
<minimum>
<numerical-constant unit="h" value="1"/>
</minimum>
<maximum>
<numerical-constant unit="h" value="2"/>
</maximum>
</duration>
</time-range>
<self/>
</time-annotation>
</resource-constraint>
<costs name="monetary-costs">
<numerical-constant unit="Euro" value="1000"/>
</costs>
<costs name="discomfort">
<qualitative-constant value="low"/>
</costs>
</preferences>
Ziele:
Darstellung und Erfassung von med. Wissen
Untersützung med. Therapieplanung durch zeitorientierte skeletale Pläne
Erstellung, Durchführeung und Adaption von klinischen Protokollen durch das med. Personal
Frage 24: Werkzeuge der Guideline-Modellierung[Bearbeiten | Quelltext bearbeiten]
Frage: Was versteht man unter modell-zentrierten bzw. dokumenten-zentrierten Werkzeugen zur Leitlinien-Modellierung? Beschreiben Sie ein Werkzeug.
- Leitlinien-Modellierung: Um Leitlinien maschinen-verarbeitbar zu machen und in ein klinisches Decision-support-system zu integrieren, ist es notwendig, ihre Semantik in einer formalen Sprache zu repräsentieren. Es wurden mehrere Formalismen entwickelt, die dazu verwendet werden können (GLIF, PROforma, GUIDE, GLARE, ...).
- Werkzeuge zur Leitlinien-Modellierung: Sind notwendig, um die Leitlinien nicht manuell in den Formalismus übertragen zu müssen. Das spart Zeit und hilft, Komplexität zu bewältigen. Es gibt im Groben zwei Ansätze, wie Werkzeuge die Modellierung unterstützen: den Modell-zentrierten und den Dokumenten-zentrierten Ansatz. Die beiden Ansätze unterscheiden sich bezüglich der Umsetzung der Leitlinie in den Formalismus.
- Modell-zentrierter Werkzeug-Ansatz: Domain Experts (z.B. Ärzte) verwenden das Tool und versuchen, die Bedeutung der Leitlinie in der Sprache des Formalismus (z.B. Ontologien) zu repräsentieren. (Beispiel: Protégé) Da das Tool nicht direkt mit dem vorliegenden Leitlinien-Text arbeitet, ist der Zusammenhang Leitlinie<->Leitlinien-Modell indirekt.
- Dokumenten-zentrierter Werkzeug-Ansatz: Der User des Tools markiert Textstellen im Leitlinien-Text, um ein semi-formales Modell (z.B. XML) der Konzepte, die in der Leitlinie vorkommen, zu erstellen. Dadurch wird der Zusammenhang Leitlinie<->Leitlinien-Modell explizit und nachvollziehbar. (Beisipel: GEMCutter)
- Beschreibung des Werkzeugs Protégé: Protégé ist ein allgemeiner Ontologie-Editor, der nicht nur zur Guideline-Modellierung verwendet wird. Protégé ist dank Java plattform-unabhängig. Das User-Interface ist durch Widgets erweiterbar. Außerdem kann man den offenen Source-Code von Protégé als Java-API verwenden und damit eigene Tools bauen, die speziell auf Guideline-Modellierung zugeschnitten sind. Man kann die Ontologien auf zwei Arten modellieren:
- in der Web Ontology Language (OWL)
- mit dem Protégé Frame Editor (alle Entitäten der Ontologien werden als Frames interpretiert). Wenn man ihn benutzt, wird das Open Knowledge Base Connectivity protocol (OKBC) unterstützt. OKBC ist eine allgemeine Schnittstelle auf Ontologien (ähnlich wie ODBC Zugriff auf mehrere Datenbanken ermöglicht).
Protégé wird von einigen Guideline-Formalismen verwendet (GLIF, EON, PROforma). Zu diesen Zweck sind auch entsprechende Plugins verfügbar, wobei die Bedienung für einen Domain Expert zunächst Schwierigkeiten bereiten wird.